ラマン分光法による高濃度モノクローナル抗体の評価
抗体医薬品の評価におけるラマン分光法の有効性
抗体医薬品は、悪性腫瘍細胞の増殖や免疫細胞の活性を抑制する目的で用いられており、治療法の確立されていない疾患への応用が期待される研究分野です。しかし、抗体医薬品は、製造、輸送、保存状態などの影響により、凝集体を形成することが報告されています。抗体医薬品の凝集は、薬理作用の低下のみならず免疫原性の原因の一つとも考えられているため、抗体医薬の凝集を防ぐ処方を開発・提供するために、製造から投与までの過程で、いつ、どのように、なぜ凝集が起こるのかを明らかにする研究開発が盛んに行われています 1-4)。
ラマン分光法は、固体および水溶液中のタンパク質に対して、非破壊かつ前処理なしで二次構造および三次構造の情報を取得できる手法として有用です。顕微鏡による測定から繊維を用いたプロセスモニタリングまで幅広く応用できるため、物理化学的特性の評価や抗体医薬の品質監視の手法として注目されています 5)。
モノクローナル抗体の熱変性解析
Fig.2 に以下の各条件でのラマンスペクトルを示します。ラマンスペクトルは、ラマン分光光度計 NRS-4500 で測定しています。
- 非加熱試料:加熱していない MabThera®
- 50 °C 加熱試料:50 °C で 10 分間加熱した MabThera®
- 80 °C 加熱試料:80 °C で 10 分間加熱して生成した凝集体
※ 凝集体のスペクトルを除き、バッファーのスペクトルは減算しています。
各スペクトルにおいて、Table.1 に示すタンパク質の二次構造および三次構造に特徴的なピークを明確に観察することができました。

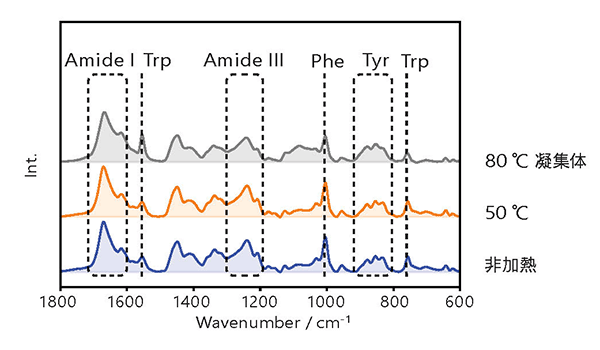
(各スペクトルはアミドIのバンドで規格化)
| Raman Shift | Assignment |
|---|---|
| 1650 cm-1 | Amide I |
| 1555 cm-1 | Tryptophan |
| 1300 cm-1 | Amide III |
| 1000 cm-1 | Phenylalanine |
| 850 cm-1 | Tyrosine |
| 750 cm-1 | Tryptophan |
アミド I の二次微分バンドは、非加熱試料と 50 °C 加熱試料で一致していますが、80 °C 加熱試料ではピークのシフトが認められ、二次構造が変化していることがわかります(Fig.2a)。
また、トリプトファンに由来する 1550 cm-1 のバンドも、非加熱試料と 50 °C 加熱試料とでは、80 °C 加熱試料のバンド形状に変化が見られ、三次構造が変化していることがわかります(Fig.2b)。
チロシンに由来するトリプレットバンドについても、同様の変化が観察されました(Fig.2c)。
これらのバンドにカーブフィッティングを行ったところ、I850 / I830 の強度比が 80 °C 加熱試料で増加し、凝集過程でチロシンのフェノール性 -OH 基がドナーからアクセプターに変化したことが示されました 5)。
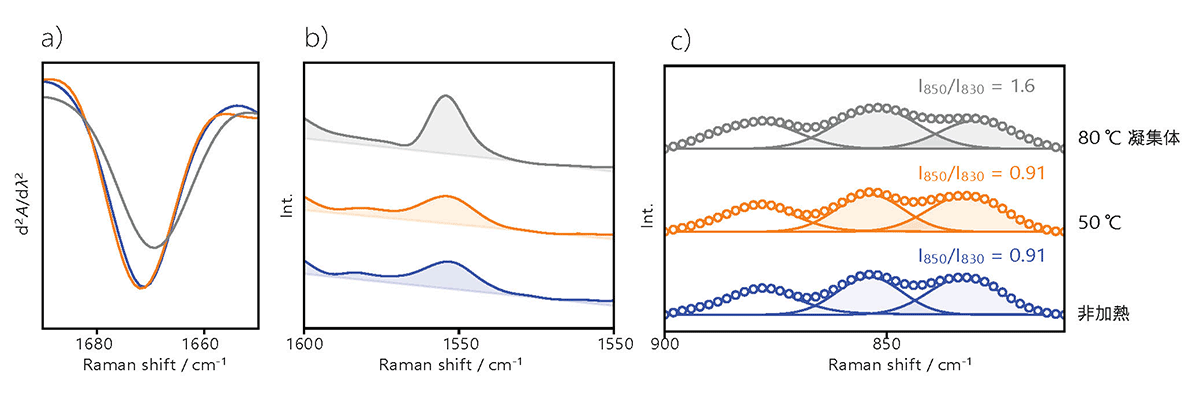
(各スペクトルはアミド I のバンドで規格化)
抗体溶液の定量測定
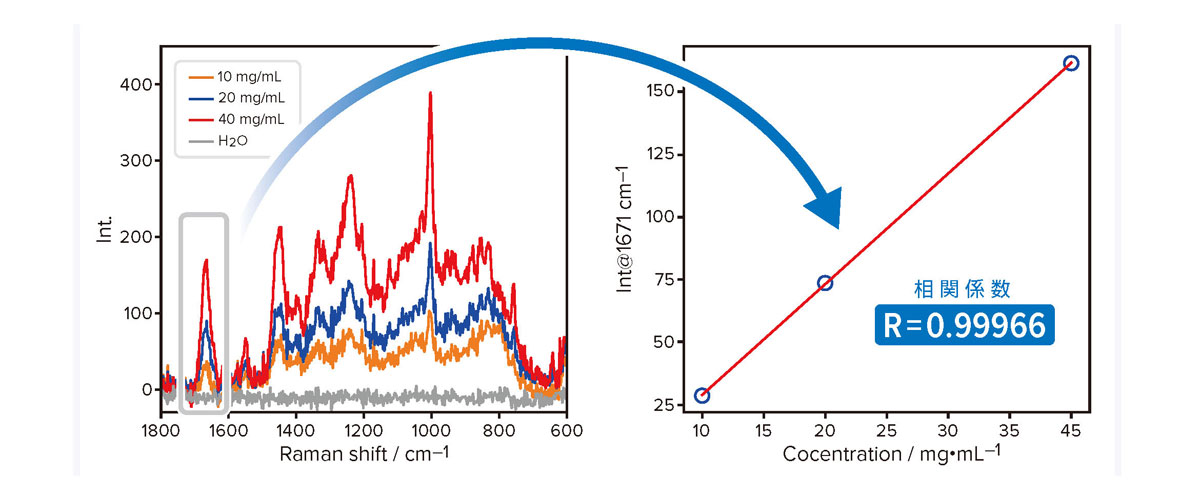
顕微ラマンよりも手軽に測定できるラマン分光光度計として、パームトップラマン分光光度計をラインアップしています。
一般的な石英セルを使用することで、抗体溶液中の有効成分を簡便かつ高い再現性で定量可能です。
抗体溶液を処方濃度のまま測定することができ、相関性の高い検量線を取得することができます。

1) Y. Yunyu and L. Zang: Am. Pharm. Rev., 21(2),(2018)
2) Wei Bingchua, Woon Nicholas, Dai Lu, Fish Raphael, et al.: MAbs, 14(1), e2007564 (2022)
3) Ilokugbe Ettah and Lorna Ashton: Antibodies, 7(3), 24 (2018)
4) 内山進. “抗体医薬品の凝集に関する現状と展望”. Seibutsu kōgaku kaishi. 公益社団法人 日本生物工学会, 2023. 101(7): 350–352.
5) Bethan S. McAvan, Leo A. Bowsher, Thomas Powell, John F. O’Hara, Mariangela Spitali, Royston Goodacre, and Andrew J. Doig: Anal. Chem., 92(15), 10381 (2020)
6) Nikki Kuhar, Sanchita Sil, Taru Verma and Siva Umapathy: RSC Adv., 8, 25888 (2018)






