超臨界流体の基礎(1) 超臨界流体とは?
超臨界状態とは?
物質は温度や圧力の条件によって、固体(一定の形と体積を持つ状態)・液体(一定の体積を持つが形が自由に変わる状態)・気体(一定の形や決まった体積を持たない状態)という3つの状態をとります。たとえば、水は常温・常圧では液体ですが、常圧では100 ℃で水蒸気になり、0 ℃で氷になります。このように物質の状態が変化することを状態変化といいます。
それでは、超臨界状態とはどのような状態か考えてみましょう。内部を真空にした密閉容器に水を半分入れます。容器の内部では水が蒸発し、上部が気相、下部が液相となります。この容器を加熱していくと、下部の液相である液体の水は膨張しながら蒸発していくため、密度が減少していきます。一方、上部の気相である水蒸気は下部の液相から水蒸気が供給されるため密度が増加していきます。
このとき、ある温度における容器内の最大圧力は、その温度における水蒸気の飽和蒸気圧によって決まります。つまり、ある温度で容器内の圧力が飽和蒸気圧未満であれば、液体の水が蒸発して圧力が飽和蒸気圧まで上昇します(図1)。逆に容器内の圧力が飽和蒸気圧以上であれば、水蒸気が凝縮して、圧力が降下します。
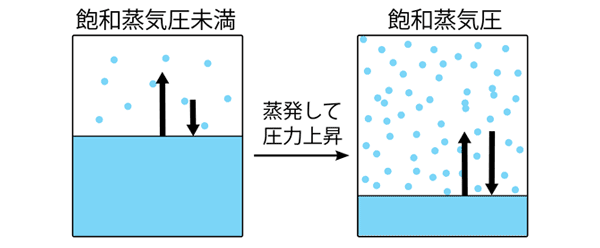
容器をどんどん加熱していくと、容器内の圧力は温度の上昇とともに高くなります。やがて、液体の水の密度と水蒸気の密度が同じ値になります。このとき、全体が液体の水と水蒸気の区別がつかなくなり、一つの相となります。

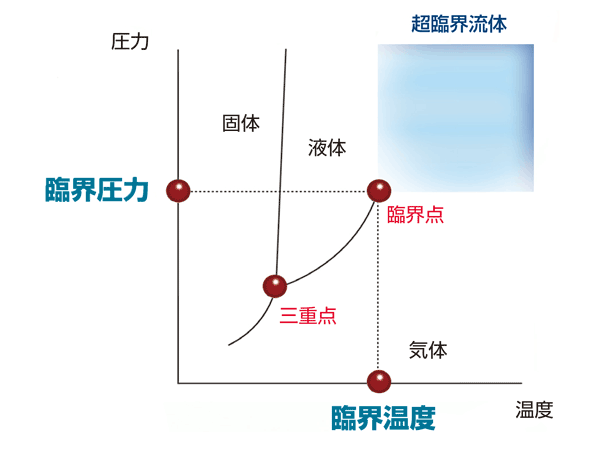
超臨界状態の水は、そこから圧力をいくら高くしても液体になることはありません。例えるなら、液化しない高密度の気体のような状態と言えるでしょう。これを超臨界状態といい、超臨界状態にある物質を超臨界流体といいます。物質が超臨界状態になる温度と圧力を臨界点といい、温度を臨界温度、圧力を臨界圧力といいます。下記に物質の相図と様々な物質の臨界圧力と臨界温度を示します。
| 物質 | 臨界温度(℃) | 臨界圧力(MPa) |
|---|---|---|
| NH3 | 132 | 11.28 |
| CO2 | 31 | 7.38 |
| NO2 | 36 | 7.24 |
| H2O | 374 | 22.06 |
| C3H8 | 97 | 4.25 |
| C6H14 | 234 | 2.97 |
| CH3OH | 239 | 8.09 |
| C2H5OH | 243 | 6.38 |
| C6H5(CH3) | 318 | 4.11 |
超臨界流体の物性
超臨界流体の密度は液体に近く、物質を溶解する能力を有します。粘性は液体より気体に近い値を示し、超臨界流体中の物質の移動速度(拡散係数)は液体と気体の中間くらいになります。
| 気体 | 超臨界流体 | 液体 | |
|---|---|---|---|
| 密度[kg/m3] | 1 | 100~1000 | 1000 |
| 粘度[mPa・s] | 0.01 | 0.1 | 1 |
| 拡散係数[m2/s] | 10−5 | 10−7~10−8 | 10−10 |
| 熱伝導率×10−3[W/(m・K)] | 5~30 | 20~150 | 50~200 |
総じて、超臨界流体は液体と気体の中間の性質を示し、温度と圧力を変えることによって物性を大きく変化させることができます。これにより、超臨界流体はクロマトグラフィーの移動相溶媒、抽出操作の溶媒、化学反応の溶媒(分解・合成)など様々な用途に使われています。
JASCO Web Seminar 『超臨界流体とは何?』
超臨界流体の概要をご紹介した動画になります。ぜひご覧ください。



 超臨界流体の基礎 目次
超臨界流体の基礎 目次

