高性能蓄電池の開発に資する分析・分光技術 ~リチウム硫黄電池の電池特性と劣化因子の評価~

大容量電池としてのリチウム硫黄電池及び分光技術の果たす寄与
正極に分子状の単体硫黄(S8)、負極に金属 Li を用いる「リチウム硫黄電池(Li-S 電池)」は、次世代の革新型二次電池システムの実現のために精力的に研究されている1)。S8 は硫黄原子が環状に結合した化合物であり、火山国である本国日本においては非常に安価に採掘され、汎用的な Li イオン電池の正極に含まれる遷移金属で懸念される資源的・コスト上の懸念が極めて少なく、安価かつ毒性の小さい電池材料として期待される。
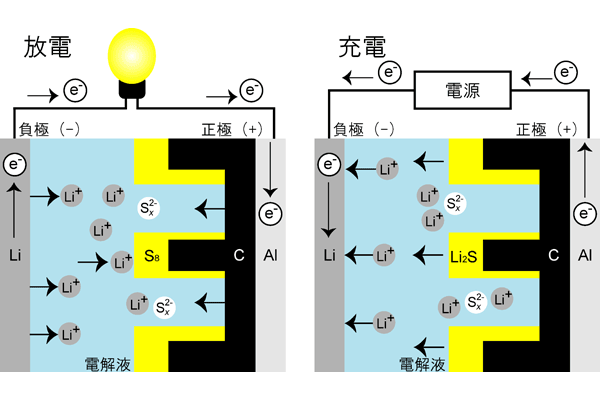
この電池系の充放電反応時の断面イメージを図1に示す。
1) X. Ji, K. T. Lee, L. F. Nazar, Nature Mater., 8, 500 (2009).
Li2Sx という多硫化リチウム(Li ポリスルフィド)を x の値を x=8 から1まで広く変化させながら多様な形態を取ることになり、その間には 16 電子移動反応という非常に多くの反応電子が関与する反応が起こる。
そのため、この S8 の正極重量当たりの理論容量は 1,672 mAh g-1 という高い値を示し、これは汎用的な Li イオン電池に用いられる正極の1つである LixCoO2(0.5 < x < 1; 137 mAh g-1)、LixMn2O4(0 < x < 1; 148 mAh g-1)などの遷移金属化合物ベースの電極材料のほぼ 10 倍と極めて高い。
しかし、S8 を Li 電池の新しい正極材料として用いるには、以下に示す本質的な課題が存在した。
- Li 挿入・脱離に伴う大きな体積膨張・収縮
- S8 から Li2Sx の領域における低い導電率(2 < x < 8、多硫化リチウムの中間体)
- S8 から Li2Sx の領域における電極反応速度の遅さ
- Li2Sx の高い溶解性に伴う電解液中への溶出
これによりセル容量は急速に低下し、充電/放電間の電気量効率を示すクーロン効率も低下する。これを克服すべく、Li2Sx の溶解を抑制し、セルの導電性を高めるために、高秩序化が実現されたナノ構造の S8 / カーボン複合材料や表面被覆1)、および添加剤の適用などが研究されてきている。
1) X. Ji, K. T. Lee, L. F. Nazar, Nature Mater., 8, 500 (2009).
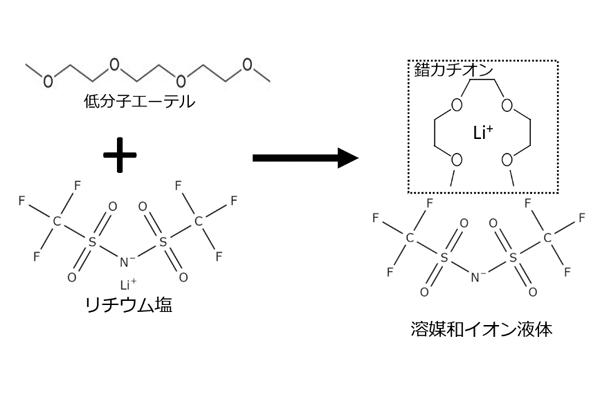
一方、低分子量エーテル(ある種のグライム類)と高濃度の Li 塩からなる「溶媒和イオン液体」は、リチウム硫黄電池の電解液として効果的であると報告された2)。
エーテル中の酸素原子と Li カチオンが強く溶媒和し(図2)、所謂錯カチオンの配位構造を取ることにより、過渡的にはカチオン・アニオンのみからなるイオン液体3)のように振る舞う新しいタイプの電解質種として期待された。
機能的観点からは、エーテルの溶媒分子単体と比べて熱的および電気化学的安定性も飛躍的に改善することも見いだされている。
更に、溶媒和イオン液体は極めて低いルイス酸/ルイス塩基性を有し、Li-S 電池の充放電反応時に生成する Li2Sx の溶解性を著しく低減できると期待された。
2) K.Yoshida, M.Nakamura, Y.Kazue, N.Tachikawa, S.Tsuzuki, S.Seki, K.Dokko, M.Watanabe, J.Am.Chem.Soc., 133, 13121 (2010).
3) P. Wasserscheid, W. Keim, Angew. Chem. Int. Ed., 39, 3772 (2000).
適切な溶媒和4)の効果を利用することにより、Li2Sx の溶解性が制御できる一例を示そう。
図2に Li2S8 を飽和濃度に溶解させた低分子エーテル(トリグライム、G3、図2中に記載)と Li 塩である LiTFSA の混合液体、[Li(G3)x][TFSA] の外観を示す。
即ち、x の値が小さくなるほど Li 塩は高濃度となり、x=1 の際には G3 と LiTFSA は等モル比の混合物となる。Li2S8 は Li-S 電池の充放電における正極の反応中間体であり、電解液に容易に溶解することが知られている。
Li2S8 を飽和溶解させた溶媒和イオン液体は LiTFSA 濃度を高くするに伴い、明確な色濃度の低下傾向を示した。すなわち、LiTFSA 濃度を単純に変化させるだけで、遊離 G3 を減少させ、Li2S8 の溶解を抑制することが単純な溶解実験において視覚的に確認できた。
Li2S8 の溶解性抑制を定量的に把握するため化学的に構造を崩さない非配位性のフッ素系溶媒4)で希釈した後に、UV-vis スペクトルを測定した(図4、使用機種:V-630、日本分光)。
遊離 G3 が多量に含まれると考えられた x=1 以上の組成域においては測定波長が 400 nm 以下では測定器の測定限界を超える、極めて高い溶解傾向が見て取れる一方、等モル比以上の高濃度域では検出ピークは著しく低くなり、Li2S8 の溶出を抑えられる結果を得た5)。

![UV-vis spectra of [Li(G3)x][TFSA]saturated with Li2S8.](/img/technique/topics/lis_battery/fig3.png)
※図4は論文 5) より転載
4) K. Takahashi, Y. Ishino, W. Murata, Y. Umebayashi, S. Tsuzuki, M. Watanabe, H. Takaba, S. Seki, RCS Adv., 9, 24922 (2019).
5) Y. Ishino, K. Takahashi, W. Murata, Y. Umebayashi, S. Tsuzuki, M. Watanabe, M. Kamaya, S. Seki, Ener. Tech., 1900197 (2019).
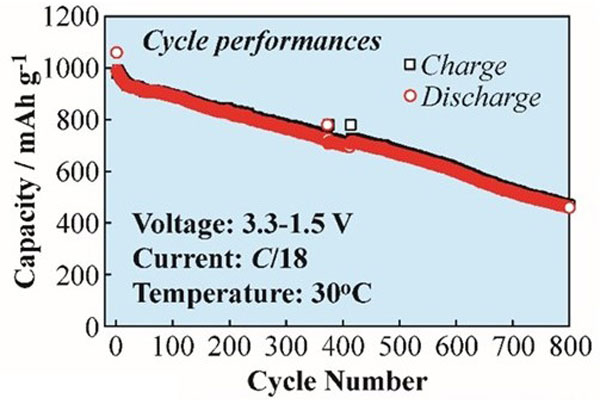
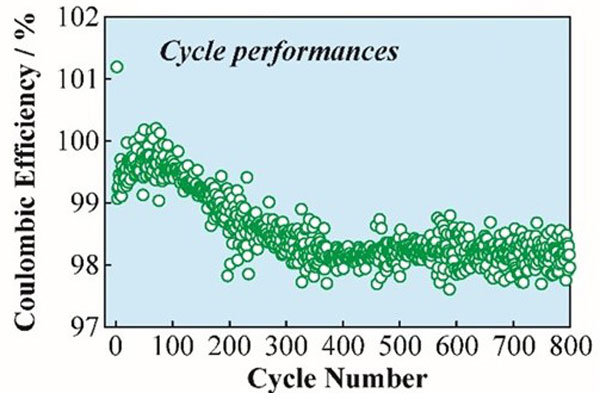
Li-S 電池はそのエネルギー密度の高さから、定置用などの大型蓄電用途への展開が最も期待される。この実用化を見据えた場合には、通常民生用途より長い寿命の動作が必要となり、10年間の耐久寿命、言い換えると 3,500 サイクル程度の長期寿命性能が必要となる。
現状、当研究グループが達成している最も長期性能に優れる Li-S 電池のサイクル特性を図5と図6に示す。実用化を見据えられる 800 サイクルに渡る安定な充放電作動を可能とし、基本的な電池安定作動のコンセプトが成立していると考えられた6)。
また、Li-S 電池の劣化因子である、多硫化リチウム Li2Sx 自身の絶対溶解量を定量するためには、溶解する Li2Sx の濁度測定が有効である。
変則的な使用方法の範疇とはなるが、高感度の Li2Sx 溶解度の定量分析法として分光蛍光光度計(使用機種:FP-8300、日本分光)を用いて散乱光を検出し、比ろう分析法による濁度測定を行った。

図8(a)に 0 °C、40 °C、90 °C における Li2S8 を溶解させた [Li(G3)1.25]TFSA 溶媒和イオン液体の外観を示す。90 °C の高温では Li2S8 が完全溶解し透明となるが、低温では Li2S8 が析出し白濁し Li2S8 の溶解度は温度依存性を有することが確認された。

図8(b)に散乱光測定の結果の一例を示す。[Li(G3)1.25]TFSA 中に約 430 ppm の Li2S8 を高温で溶解させたサンプルを例として示すが、50 °C では散乱光が検出されないが、保持温度を徐々に低下させ 45 °C から 44 °C に変更した際、15,000秒あたりから散乱光の急激な増加が検出された。
この結果より、散乱光を用いた濁度測定により Li2Sx の溶解度と測定温度の関係は誤差 1 °C の高い精度で定量できることがわかった。
濁度測定により Li2Sx 溶解度の定量が可能となったため、[Li(G3)1.25]TFSA に高温溶解させる多硫化リチウム(Li2S8)の添加量、および Li2Sx の化学組成を変化させ、飽和溶解度と温度の関係定量を行った。
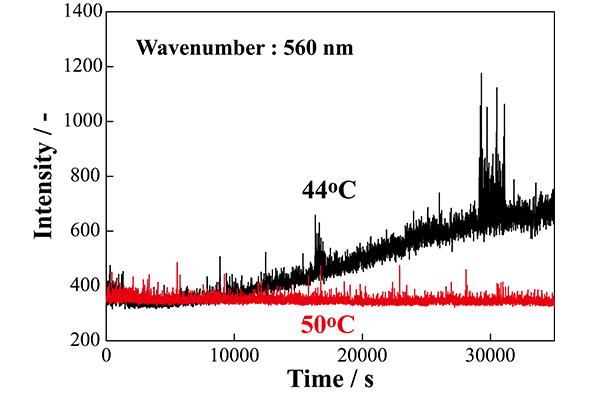
図8(c)に [Li(G3)1.25]TFSA 及び、Li-S 電池に有用な電解液系とされるスルホラン(SL)を用いた、4SL+LiTFSA、2SL+LiTFSA の其々において、Li2Sx の飽和溶解度と温度の関係を示す。
[Li(G3)1.25]TFSA に対する Li2Sx の溶解度は温度の絶対値に対し、直線的に変化する結果となった。この結果より高温域で Li2S8 が不均化反応を起こし、Li2S4 や Li2S2 等が存在している可能性が示唆された。
また、溶解度は一般的な温度特性として知られるアレニウス則に従わないことが分かり、Li-S 電池は従来の蓄電池とは劣化機構が異なり比較的良好な高温性能を持つ可能性を示唆するものであった。
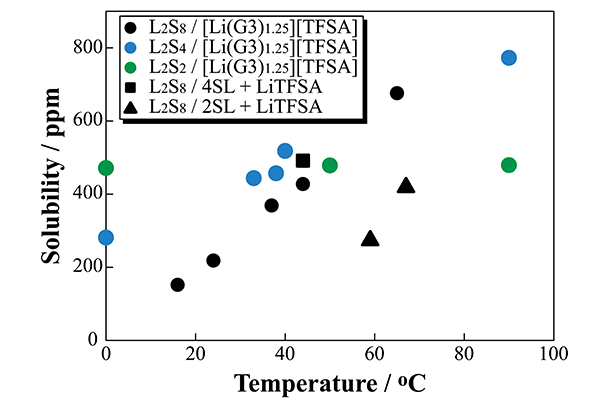
更に、SL 系電解質に対する Li2Sx の溶解実験からは 4SL+LiTFSA より 2SL+LiTFSA のほうが高温において溶解度が低い結果を得た。これは Li 塩の組成が高くなりフリーな SL 溶媒が減少し Li2Sx の溶解が抑制されたためと考えられる。溶解させる Li2Sx 組成を変化させた結果、S8 の還元の進行(Li2S8→Li2S4→Li2S2)に伴い、溶解度の温度依存性が低下することがわかった。
これは、電池作動時を考えると高温では放電時に S8 が Li2S8 へ還元される過程において高温時に劣化が最も加速されると予想され、Li-S 電池の劣化に直接関与する Li2Sx の組成は温度に伴い変化する可能性を示唆する結果となった。
詳細に関しては、Jasco Report Vol.64 No.1『高性能蓄電池の開発に資する分析・分光技術』(著者:関志朗*1、高橋圭太朗*1、平岡紘次*1、釜谷美則*1、高羽洋充*1、梅林泰弘*2 *1:工学院大学大学院 化学応用学専攻、*2:新潟大学大学院 自然科学研究科 所属は発行時)をご参照ください。
以下よりダウンロードできます。


