HPLCを用いたアミノ酸分析
アミノ酸分析における誘導体化の必要性
一般的にアミノ酸の分析にはHPLCが使われます。ほとんどのアミノ酸はそのままではUV検出や蛍光検出ができないため、HPLCを用いて選択的または高感度に測定するためには、誘導体化を行う必要があります。
サンプルを適切に前処理(液体はろ過、固体は抽出+ろ過、必要に応じて加水分解)
↓
アミノ酸はUV吸収が乏しく、そのままの形態では検出することが困難
↓
特定の試薬と反応させ、検出できる形態に変化させる(誘導体化)
↓
分離する前に誘導体化する方法(→ プレカラム誘導体化)
分離の後に誘導体化する方法(→ ポストカラム誘導体化)
↓
誘導体化法を目的に応じて選択し、それに併せて誘導体化試薬、カラムを選択
↓
分析
↓
アミノ酸はUV吸収が乏しく、そのままの形態では検出することが困難
↓
特定の試薬と反応させ、検出できる形態に変化させる(誘導体化)
↓
分離する前に誘導体化する方法(→ プレカラム誘導体化)
分離の後に誘導体化する方法(→ ポストカラム誘導体化)
↓
誘導体化法を目的に応じて選択し、それに併せて誘導体化試薬、カラムを選択
↓
分析
誘導体化がもたらす利点
- 検出の高感度化
- 検出選択性の向上
- 分離の向上(プレカラム)
アミノ酸分析における分離と検出
分離方法
アミノ酸を誘導体化した後に分離1)またはアミノ酸をそのまま分離2)1) C18(ODS)カラムによる逆相系分離 → 主にプレカラム誘導体化法
2) 強酸性陽イオン交換樹脂(Na型、Li型)カラムによるイオン交換系分離 → ポストカラム誘導体化法
検出方法
アミノ酸が有するアミノ基と反応させた誘導体化物を 蛍光検出器 または 紫外可視吸光度検出器 で検出する1) 誘導体化物が蛍光性を持つ → 蛍光検出器
2) 誘導体化物がUV吸収を持つ → 紫外可視吸光度検出器
プレ/ポストカラム誘導体化法
プレカラム誘導体化(カラムに注入する前に誘導体化)
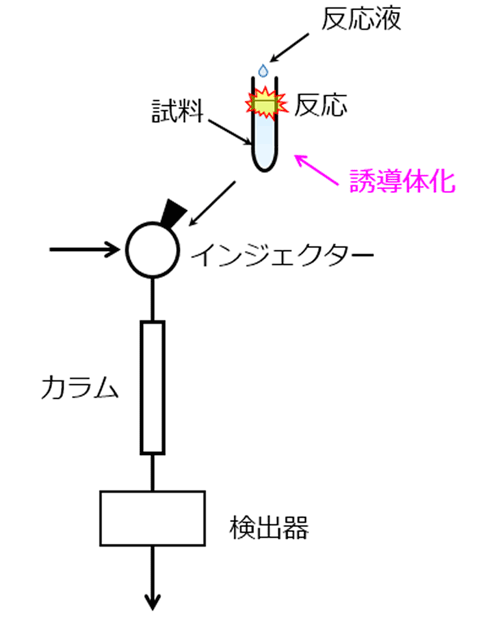
マニュアル操作による誘導体化またはオートサンプラーの自動誘導体化機能などを用い、アミノ酸をあらかじめ誘導体化した試料をHPLC装置に注入する方法です。アミノ酸誘導体化物はODSカラム等による逆相系で分離した後、検出します。
ポストカラム誘導体化(カラムで分離した後で誘導体化)
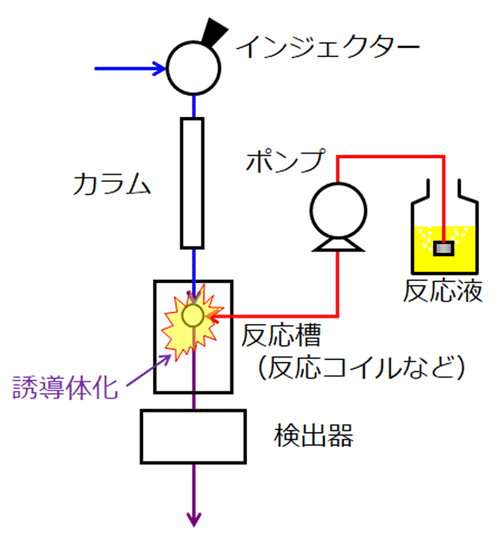
アミノ酸をそのままHPLC装置に注入し、イオン交換系カラムで分離します。カラムからの溶出液をオンラインで反応液と混合し、反応コイル内で誘導体化したアミノ酸誘導体化物を検出します。
アミノ酸誘導体化の反応機構
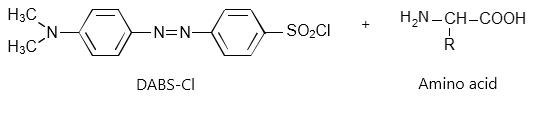
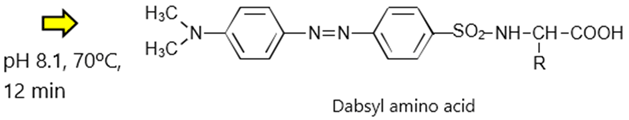
ダブシルクロライド(DABS-Cl)を反応試薬として用いたプレカラム誘導体化法
ダブシルクロライドは、α-アミノ基、ε-アミノ基、フェノール性水酸基、イミダゾール基と反応します。α-アミノ基との反応式を下記に示します。
<DABS-Clとα-アミノ基の反応>
特徴
- 0.5µgのタンパク質やペプチドのアミノ酸組成を正確かつ再現性良く分析
- 誘導体化アミノ酸は高い安定性を持つ(室温1ヶ月)
- 誘導体化アミノ酸を可視領域(465 nm)で検出
⇒UV吸収をもつ夾雑物質による影響を受けず、高感度分析が可能
オルトフタルアルデヒド(OPA)を反応試薬として用いたポストカラム誘導体化法
<OPAとアミノ酸の反応>
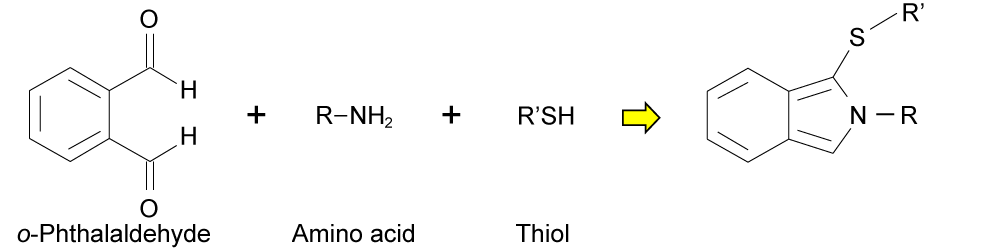
特徴
- 室温でも素早く反応(システムでは、カラムと同じ温度で反応)
- 反応速度は、アミノ酸によって異なる。
- 反応生成物は、不安定(反応後、分解も始まっている。)
- 蛍光検出による高感度検出が可能
- 検出波長 Ex: 340 ~ 350 nm、Em: 450 ~ 460 nm
- 感度:数100 fmol
ニンヒドリンを反応試薬として用いたポストカラム誘導体化法
<ニンヒドリンとアミノ酸の反応>
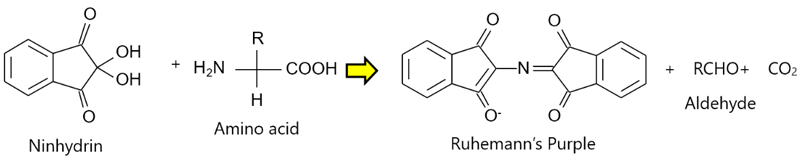
特徴
- 反応は、110℃以上
- 検出波長は、1級アミンと2級アミン(プロリン、ハイドロキシプロリンなど)で異なる。
1級アミンは 570 nm、2級アミンは 440 nm - 感度:数10 pmol(OPAのポストカラム誘導体化法と比較して、検出感度が2ケタ低い)
クロロギ酸 9-フルオレニルメチル(FMOC)を反応試薬として用いたプレカラム誘導体化法
<OPA とアミノ酸の反応>
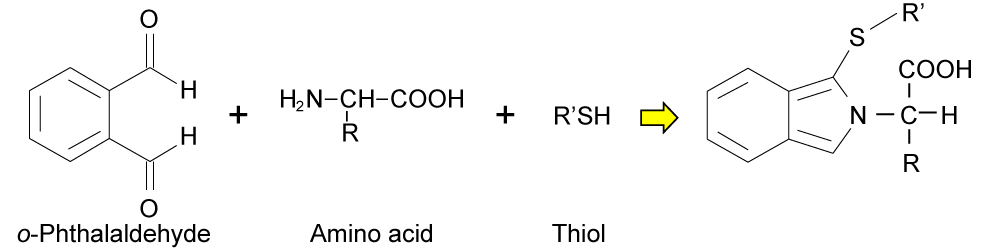
<FMOC と 2級アミノ酸の反応>
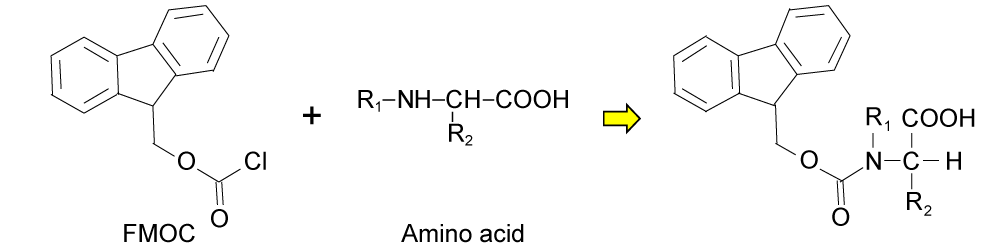
特徴
- 室温でも素早く反応(システムでは、カラムと同じ温度で反応)
- 反応速度は、アミノ酸によって異なる
- 反応生成物は、不安定(反応後、分解も始まっている)
- 蛍光検出による高感度検出が可能
- 検出波長:
OPA; Ex 340 ~ 350 nm, Em 450 ~ 460 nm
FMOC; Ex 266 nm, Em 305 nm -
感度:
OPA; 数100 fmol
FMOC; 100~200 fmol
↑
 HPLCを用いたアミノ酸分析
HPLCを用いたアミノ酸分析
 アミノ酸分析の必要性
アミノ酸分析の必要性


