分光蛍光光度計の基礎
分光蛍光光度計の基礎(1) 蛍光とは?
蛍光とは?
「蛍光」は、私達の身のまわりに多く存在しています。物質には、エネルギーを吸収するとそのエネルギーを光で放出するものがあります。この発光現象を、一般にルミネッセンスと言います。ルミネッセンスには様々な種類があります。分光蛍光光度計で測定する「蛍光」は、光(紫外・可視光)のエネルギーを吸収し発光するフォトルミネッセンスの一種です。

洗剤

白色LED

蛍光ペン

蛍光灯

紙幣(特殊インク)
図1 身のまわりの蛍光体
光の吸収と発光
光子はE = hν = hc/λ(E: エネルギー、h: プランク定数、ν: 振動数、c: 光速、λ: 波長)で表されるエネルギーを持っています。光を分子に照射すると、光の持つエネルギーが分子に吸収される場合があります。光エネルギーの吸収により、安定で低いエネルギー状態(基底状態)にあった分子は、一時的に不安定で高いエネルギー状態(励起状態)に移動(遷移)します。その後、エネルギーを放出して安定な基底状態に戻ります。このとき、エネルギーを光として放出する現象のことを発光と言います(図1)。吸収したエネルギーの一部は熱として放出されるため、発光の光子エネルギーは吸収した光の光子エネルギーよりも低く、波長は長くなります。
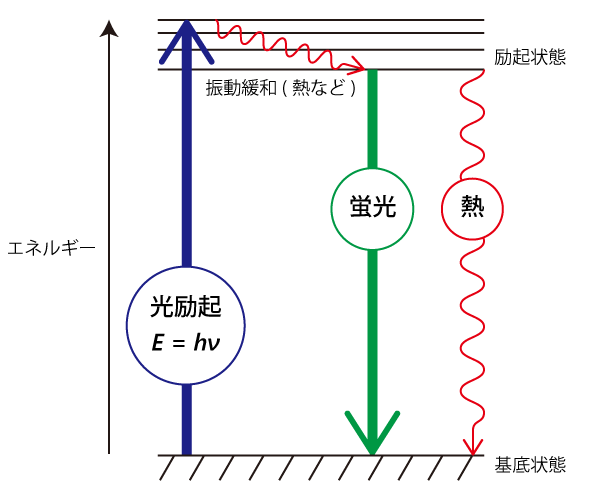
図2 発光の種類とエネルギー図
蛍光とりん光の違い
原子核のまわりに分布する電子は、エネルギーの低い原子軌道や分子軌道から順に配置されます。各軌道には電子が二つずつ入りますが、それぞれの電子の自転の向き(スピン)は互いに逆になります(パウリの排他原理)。
光を吸収して、一方の電子がより高いエネルギーの軌道に遷移すると、電子スピンは維持されるので、エネルギーの異なる二つの軌道にスピンが異なる電子が一つずつ存在する状態になります。この状態を励起一重項状態と呼びます。励起一重項状態の電子が再び基底状態に戻る際に、光を放出する場合があり、その光を蛍光と呼びます。
一方、励起電子が基底状態に戻る前にスピンが反転し、基底状態の電子と同じ向きになること(項間交差)があります。この状態を励起三重項状態と呼び、この状態から再び基底状態に戻る際に発する光をりん光と呼びます。励起一重項状態よりも励起三重項状態の方がエネルギーが低いので、一般に蛍光よりりん光の方が波長が長くなります。また、励起三重項状態にある電子が再び基底状態に戻る際には、スピンが反転するため、蛍光よりも発光時間は長くなります。このため、蛍光寿命がナノ秒オーダー程度であるにの対し、りん光寿命はマイクロ秒からミリ秒オーダーとなります。
光を吸収して、一方の電子がより高いエネルギーの軌道に遷移すると、電子スピンは維持されるので、エネルギーの異なる二つの軌道にスピンが異なる電子が一つずつ存在する状態になります。この状態を励起一重項状態と呼びます。励起一重項状態の電子が再び基底状態に戻る際に、光を放出する場合があり、その光を蛍光と呼びます。
一方、励起電子が基底状態に戻る前にスピンが反転し、基底状態の電子と同じ向きになること(項間交差)があります。この状態を励起三重項状態と呼び、この状態から再び基底状態に戻る際に発する光をりん光と呼びます。励起一重項状態よりも励起三重項状態の方がエネルギーが低いので、一般に蛍光よりりん光の方が波長が長くなります。また、励起三重項状態にある電子が再び基底状態に戻る際には、スピンが反転するため、蛍光よりも発光時間は長くなります。このため、蛍光寿命がナノ秒オーダー程度であるにの対し、りん光寿命はマイクロ秒からミリ秒オーダーとなります。
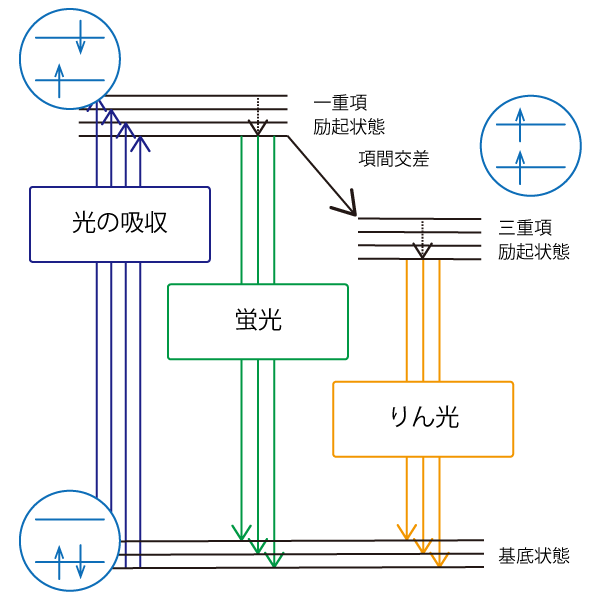
図3 蛍光とりん光の違い



 分光蛍光光度計の基礎 目次
分光蛍光光度計の基礎 目次

